58 công thức giải nhanh hóa học tổng hợp một số công thức giúp các bạn học sinh có thể giải bài tập hóa học THPT một cách nhanh chóng và thuận tiện nhất. Mời các bạn cùng tham khảo.
HÓA ĐẠI CƯƠNG
I. TÍNH pH
1. Dung dịch axit yếu HA: pH = – 1/2(log Ka + logCa) hoặc pH = –log(αCa) (1)
(Ca > 0,01M; α: độ điện li của axit)
2. Dung dịch đệm (hỗn hợp gồm axit yếu HA và muối NaA): pH = –(log Ka + logCa/Cm) (2)
3. Dung dịch baz yếu BOH: pH = 14 + 1/2(log Kb + logCb) (3)
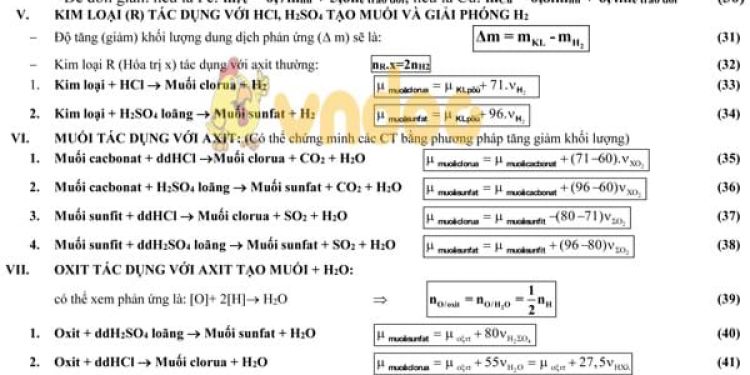
II. TÍNH HIỆU SUẤT PHẢN ỨNG TỔNG HỢP NH3:
H% = 2 – 2 MX/MY (4) (X: hh ban đầu; Y: hh sau)
%VNH2 trong Y = (MX/MY – 1).100 (5)
ĐK: tỉ lệ mol N2 và H2 là 1:3
I. BÀI TOÁN VỀ CO2
1. Tính lượng kết tủa khi hấp thụ hết lượng CO2 vào dung dịch Ca(OH)2 hoặc Ba(OH)2
Điều kiện: n↓ ≤ nCO2 Công thức: n↓ = nOH- – nCO2 (6)
2. Tính lượng kết tủa khi hấp thụ hết lượng CO2 vào dung dịch chứa hỗn hợp gồm NaOH và Ca(OH)2 hoặc Ba(OH)2
Điều kiện: nCO23- ≤ nCO2 Công thức: nCO23- = nOH- – nCO2 (7)
(Cần so sánh nCO23- với nCa và nBa để tính lượng kết tủa)
3. Tính thể tích CO2 cần hấp thụ hết vào dung dịch Ca(OH)2 hoặc Ba(OH)2 để thu được lượng kết tủa theo yêu cầu
(Dạng này có 2 kết quả)
Công thức: nCO2 = nCO2 (8) hoặc nCO2 = nOH- – n↓ (9)
II. BÀI TOÁN VỀ NHÔM – KẼM
1. Tính lượng NaOH cần cho vào dung dịch Al3+ để thu được lượng kết tủa theo yêu cầu (Dạng này có 2 kết quả)
Công thức: nOH- = 3n↓ (10) hoặc nOH- = 4nAl3+ – n↓ (11)
2. Tính lượng NaOH cần cho vào hỗn hợp dung dịch Al3+ và H+ để thu được lượng kết tủa theo yêu cầu (Dạng này có 2 kết quả)
nOH-min = 3n↓ + nH+ (12) nOH-max = 4nAl3+ – n↓ + nH+ (13)
3. Tính lượng HCl cần cho vào dung dịch Na[Al(OH)4] (hoặc NaAlO2) để thu được lượng kết tủa theo yêu cầu (Dạng này có 2 kết quả)
Công thức: nH+ = n↓ (14) hoặc nH+ = 4nAlO2- – 3n↓(15)
4. Tính lượng HCl cần cho vào hỗn hợp dung dịch NaOH và Na[Al(OH)4] (hoặc NaAlO2) thu được lượng kết tủa theo yêu cầu (Dạng này có 2 kết quả)
Công thức: nH+ = n↓ + nOH- (16) hoặc nH+ = 4nAlO2- – 3n↓+ nOH- (17)
5. Tính lượng NaOH cần cho vào dung dịch Zn2+ để thu được lượng kết tủa theo yêu cầu (Dạng này có 2 kết quả):
nOH- = 2n↓(18) hoặc nOH- = 4nZn2+ – 2n↓ (19)

Nguồn Vn.doc






Bình luận về chủ đề post